El otro día surgió un tema interesante a raíz de una conversación de Twitter. Alvy, del blog Microsiervos, escribió este artículo donde hace una interesante comparación de la paradoja del barco de Teseo y la realidad de las células de nuestro cuerpo. Al legendario barco, con el paso de los años, le fueron recambiando sus tablas de madera, piezas y componentes porque se iban deteriorando. Llegado un momento, no quedaba ninguna parte del barco original, y sin embargo lo seguimos denominando “el barco de Teseo”. No es otro barco a pesar de que físicamente todas sus partes han sido sustituidas. ¿Es un error de percepción nuestro si lo consideramos el mismo barco? Porque si el barco hubiera sido seriamente dañado por un temporal y nos vemos obligados a hacer otro barco, para nosotros será otro barco diferente, aunque el aspecto y las dimensiones sean exactamente las mismas, a pesar de que todos los componentes puedan ser indiferenciables. ¿El hacer la sustitución paulatinamente engaña nuestra intuición? Porque el resultado, sustituir todo el barco a la vez o poco a poco con los años, en el fondo es el mismo. ¿O realmente no nos equivocamos si seguimos denominando al barco de la misma manera? Si esto es cierto, ¿en dónde reside la “identidad individual” de un objeto? ¿El objeto es realmente una “idea” que tenemos de él?
Todas estas ideas pueden hacer sonreír al que de adolescente se vio impresionado por la filosofía platónica y leía ávidamente los libros del discípulo de Sócrates, y que más tarde tuvo que dejar aparte, no sin cierta reticencia, la cosmología que nos exponía Platón en sus Diálogos para abrazar una postura más acorde con sus convicciones científicas.
Sin embargo, este blog no va de filosofía, así que dejaremos de lado el trasfondo de la paradoja y volvamos al símil que nos presentaba Alvy. Efectivamente, el cuerpo humano, como el de la mayoría de los animales, se comporta como el barco de Teseo, en el sentido de que cada uno de nosotros, como seres individuales, únicos e irrepetibles, que además alojamos una mente con autoconsciencia (podríamos hablar también de mente o alma, en función de las creencias de cada uno), somos también una amalgama de recambios y sustituciones que ya no tenemos materialmente nada en común con el “yo” de hace unos meses. Alvy aludía a que, con unas pocas excepciones, las células de nuestro cuerpo se van recambiando. Las antiguas mueren, sufren apoptosis, y son reemplazadas por células nuevas. Este recambio es continuo, constante, se produce de forma continua a nivel microscópico, de manera que los tejidos no desaparecen y se van recambiando. El tejido permanece, no se altera en dimensiones, volumen, capacidad estructural o función. Así que no “parece” que cambiemos, no hay “recambios abruptos” de partes nuestras. Es un recambio sutil y constante. De tal manera que nuestros tejidos siempre cuentan con células “frescas”, nuevas, jóvenes.
Excepciones
Existen, como decía, excepciones. Unas pocas estirpes celulares en nuestro cuerpo en las que las células no se recambian. ¿Son células inmortales? No, esas células van muriendo, pero a un ritmo muy lento y no van siendo recambiadas. Y cuando morimos, las células de nuestro corazón o de nuestros cristalinos (1) tienen nuestra misma edad.
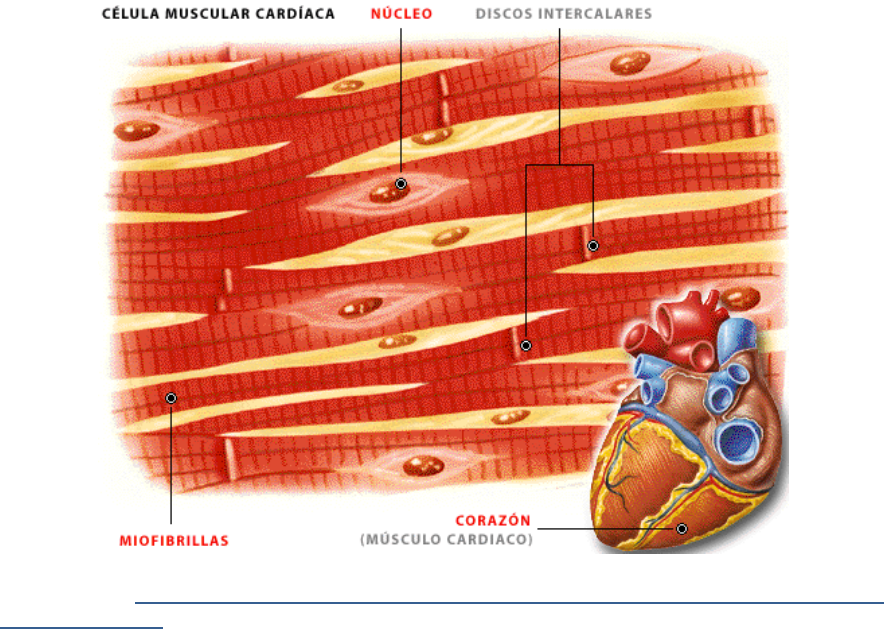
Miocitos cardiacos, células músculares que han mantenido nuestro corazón latiendo incesantemente desde antes de nuestro nacimiento (nuestro corazón comienza a latir desde la tercera semana de gestación, cuando apenas tenemos brazos ni piernas pero sí una cola como un caballo de mar, y una especie de “branquias” que nos acerca más a un animal acuático que a un humano), y han continuado trabajando sin un instante de descanso hasta que fallecemos.
Células que viven lo mismo que nosotros: 80, 90 años o más. ¿Cómo pueden estas células trabajar ininterrumpidamente, con esa carga de trabajo, con ese estrés metabólico, durante tanto tiempo? Sus proteínas, sus encimas, sus membranas, sus rutas metabólicas, ¿no se deterioran?
El caso es que sí, los componentes de estas células también se deterioran, dejan de funcionar bien. Pero, simplemente, se sustituyen. Todas las células (no solo estas pocas que no se recambien, también las células que mueren y se regeneran) están renovando constantemente sus componentes. Todas las moléculas (proteínas, ácidos grasos de las membranas celulares, glúcidos, etc) se están sustituyendo. En este sentido, cada célula es su propio «barco de Teseo». Por lo tanto, no hay una causa estricta para que una célula no pueda vivir de forma indefinida, sin necesitar ser sustituida por otra. Que la gran mayoría de las células de nuestro organismo sigan la estrategia de ser renovadas completamente y sustituidas obedece a motivos biológicos que ahora no toca hablar.
No tan excepcionales
Fijémonos en esos pocos tipos celulares que nos mencionaba Alvy en su artículo. A las células musculares del corazón y las del cristalino, en el post mencionaba las neuronas.
Si bien se consideraba hasta hace no mucho que esto último (que las neuronas no se reproducen después del nacimiento) era siempre cierto, se han encontrado excepciones de forma localizada en áreas muy concretas del cerebro. Pero la idea sigue siendo cierta para la gran mayoría de las neuronas de nuestro organismo. Las células de nuestro sistema nervioso (tanto el central, en nuestro cráneo y médula espinal, como el periférico en los nervios) nos acompañan a lo largo de nuestra vida, y proporcionalmente muy pocas surgen después de nuestro nacimiento.
A estas estirpes habría que añadir otra bastante importante: las fibras musculares estriadas. Es un tipo de miocito, de célula muscular, que no es exactamente igual a la del corazón. Su aspecto al microscopio es “estriado”, tiene estrías (bandas) debido a cómo se colocan los filamentos de las proteínas que trabajan para la contracción muscular (la actina y la miosina). Tanto el músculo cardiaco como el estriado tienen estrías (las del corazón y las demás se diferencian en cómo se coloca el núcleo o núcleos de la célula).
Por contra, existe otro tipo de músculo, el llamado músculo liso, que forma parte de arterias, venas y muchos conductos; glándulas y órganos como el esófago, estómago, intestino, la vegiga, etc. En el músculo liso sus miocitos son más pequeños y se regeneran regularmente. Los miocitos del estómago o de las arterias, por poner dos ejemplos, se van sustituyendo constantemente.
En cambio, las largas células musculares estriadas, la que componen los músculos voluntarios (las que mueven nuestros huesos y articulaciones) no suelen recambiarse. Si existe una lesión con pérdida importante de masa muscular, existe cierta capacidad de regeneración (2), aunque limitada. Sin embargo, no es la normal, sería una regeneración “por necesidad”. La norma es que las células de nuestros músculos nos acompañen en nuestra aventura por la vida. Por lo general, estas células son igual de viejas que nosotros.
Como vemos, estas “excepciones”, estas pocas estirpes celulares que no sufren una regeneración y sustitución habitualmente, ya no son tan excepcionales. Los músculos pueden ser el 40% de nuestro volumen. Además, tanto las neuronas (el cerebro y los nervios) como el músculo “normal” son tejidos y órganos “famosillos”. De los más conocidos. Eso no significa que sean más importantes, claro. Pero cuando una persona normal tiene que pensar en “cosas que hay en nuestro cuerpo», suele pensar en músculos, huesos, piel, cerebro, nervios y cosas así. No piensa en el estroma de una glándula paratiroidea, en el endotelio linfático, el canalículo biliar, el glomérulo renal o el epitelio de un bronquiolo pulmonar.
Pero la verdad es que, dejando aparte el volumen y el peso (en donde el músculo estriado gana por goleada a la mayoría de los tejidos del organismo), y la “fama”, lo conocidos que sean estos tejidos para el público general (las neuronas serían unas «celebrities»), la verdad es que hay muchas, muchas estirpes celulares diferentes en nuestro organismo. Y solo una minoría tienen esa capacidad de vivir indefinidamente, de acompañarnos en nuestra vida a lo largo de las décadas. La gran mayoría de los tejidos recambian todas sus células cada poco tiempo.
¿Cuándo vamos a hablar de ojos?
Es verdad, me he ido por las ramas. Este blog no es de filosofía, pero tampoco de histología general del cuerpo humano. Aquí hemos venido a leer cosas del ojo y del sistema visual. El caso es que, además de estas cuatro categorías celulares comentadas (neuronas, músculo estriado, músculo cardiaco y cristalino), tenemos que añadir más excepciones. Más células que no se regeneran. Y el caso es que la gran mayoría de las excepciones que quedan, ¡están en el ojo!
Es cierto que desconozco (o quizás sí lo estudié y ya no me acuerdo) si hay más excepciones relevantes fuera del globo ocular. Pero nuestro ojo, esa maravilla de la subespecialización celular, ha tenido que optar por la no regeneración celular en muchas de sus partes. Y digo que “ha tenido que”, como una metáfora, ya no hay un “diseñador inteligente” detrás. La evolución ha llegado a esa solución para obtener unos beneficios en función y estructura a costa de perder capacidad de regenerarse. Y también, y esto es muy importante (de hecho, es el tema de hoy), se pierde la capacidad de defenderse frente a enfermedades, a lesiones y la propia edad. El ojo se vuelve mejor en lo que hace, pero se vuelve más delicado. Y eso se traduce en enfermedades.
Tengo que admitir que nunca me había planteado las cosas de esta manera. Cuando estudias el funcionamiento del ojo y sus enfermedades, te metes en los detalles concretos y muchas veces pierdes la visión de conjunto. No te pones a separar tu punto de vista de los detalles y mirar el panorama de forma global. Mirar lo que ocurre desde una perspectiva de biología evolutiva. Y que una gran parte de las enfermedades más frecuentes (y por tanto, a lo que he dedicado una gran parte de mi vida profesional) se debe a esto: a este “trade-off”, a estos costes biológicos que hay que pagar por tener un ojo que funciona tan bien.
Enfermedades de la mácula
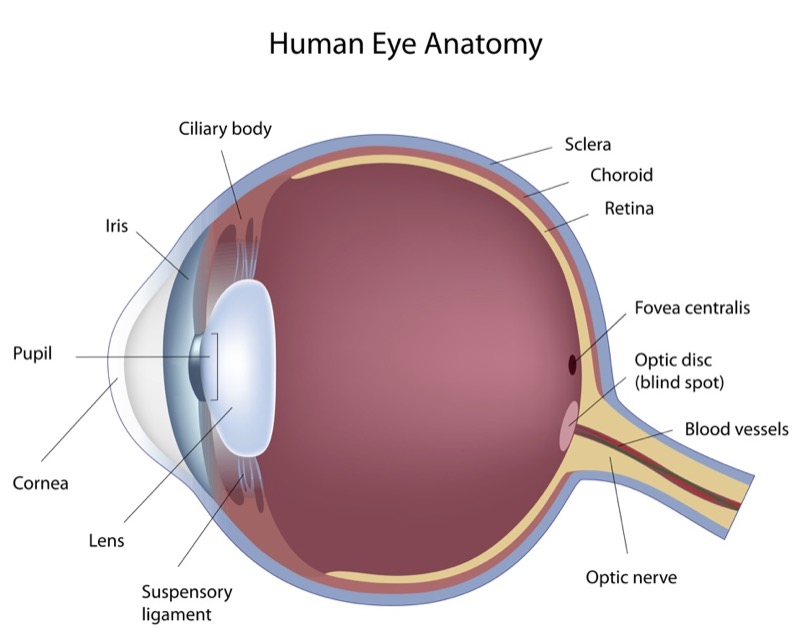
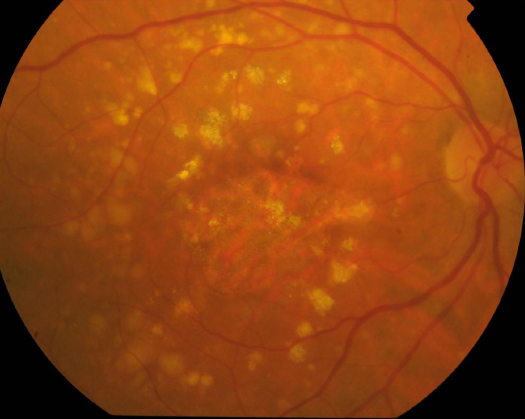
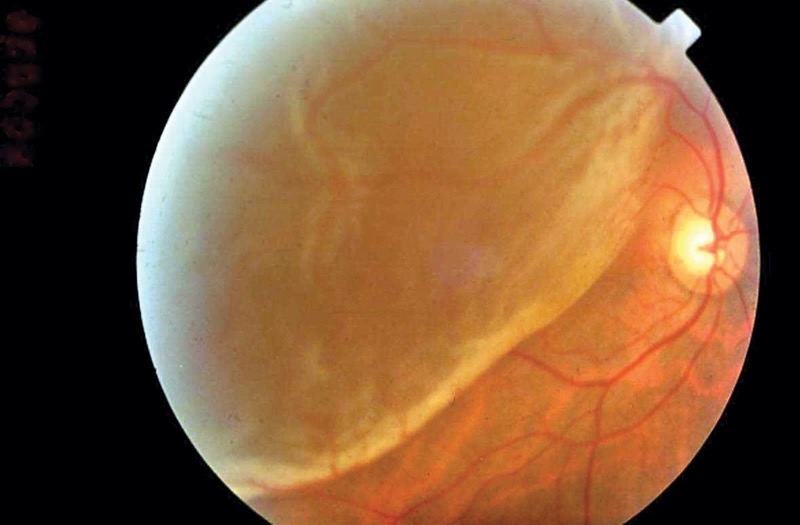
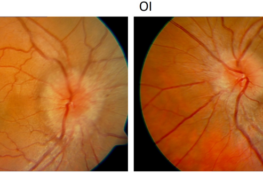
Ya hemos hablado de la degeneración macular asociada a la edad, la forma más común de enfermedad degenerativa del centro de la retina. Implica un deterioro de la mácula en la zona más externa, en la “base” de la retina, la parte que está más cerca de la coroides. El epitelio pigmentario, esa capa de células que sirven de soporte metabólico a los fotorreceptores (conos y bastones), sufren cambios degenerativos irreversibles, con acúmulo de material de deshecho (la lipofucsina es la más conocida, que suele formar lo que en la imagen de fondo de ojo se llaman drusas.
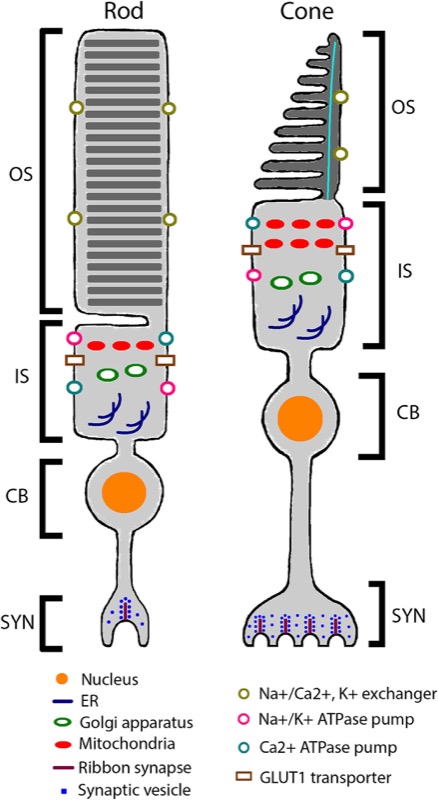
Estos cambios en el epitelio pigmentario y la zona circundante termina comprometiendo la supervivencia de los fotorreceptores. Los conos y los bastones, esas células tan especializadas, tan exigentes metabólicamente, tan demandantes de oxígeno y nutrientes, degeneran y mueren si no tienen un entorno optimizado, unas células y estructuras alrededor que estén “a su servicio”.
Así que los receptores mueren cuando el entorno no es propicio. ¿Cual es el problema? Efectivamente, estos conos y bastones, estos fotorreceptores, no se regeneran. Nacemos con un número finito y concreto, y los que vamos perdiendo no se recambian por otros. Por lo tanto, una alteración del “entorno vital” de los fotorreceptores es mucho más peligrosa: esta degeneración del epitelio pigmentario (y su membrana basal) conduce a daños irreparables, porque el fotorreceptor que muera, no puede ser reemplazado. Aunque hipotéticamente podamos mejorar ese entorno metabólico, ese ambiente que rodea al fotorreceptor, no podemos revertir el daño. Los fotorreceptores no se multiplican, y las áreas donde han muerto los conos y bastones no se pueden volver a repoblar, da igual que las circunstancias cambien a mejor.
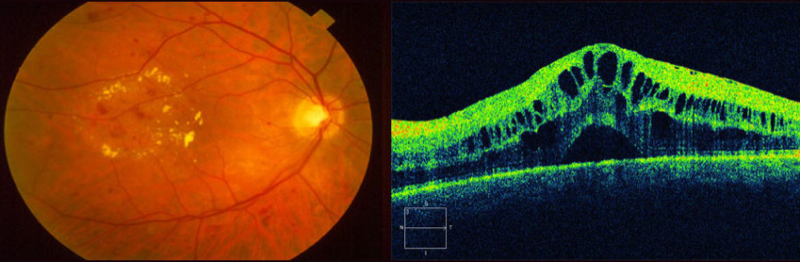
Vemos claramente lo que pasa con la degeneración macular asociada a la edad, pero ocurre algo parecido en casi todas las enfermedades de la mácula. Cuando sufrimos un edema macular (acúmulo de líquido dentro del tejido retiniano, o por debajo de éste), los fotorreceptores muchas veces se alejan, se separan del epitelio pigmentario. Su estructura y posición se desorganiza.
Si esto se prolonga un tiempo se produce un daño definitivo, irreversible. Cuando los fotorreceptores mueren, pues ocurre lo que decíamos antes: no regeneran. Podemos resolver el edema, hacer que la mácula recupere su grosor y forma habitual. Si ha pasado ya mucho tiempo, la visión no se recupera.
Y lo mismo pasa con casi todas las enfermedades de la mácula. De una manera u otra, se acaban dañando los fotorreceptores, y cuando éstos mueren, la pérdida de visión es irreversible. Lo que cause la enfermedad (falta de riego sanguíneo, daño por un exceso de radiación, etc) sólo tiene que ser capaz de acabar con las células una vez, aunque sea de forma lenta y progresiva. Aunque el daño no sea mantenido.
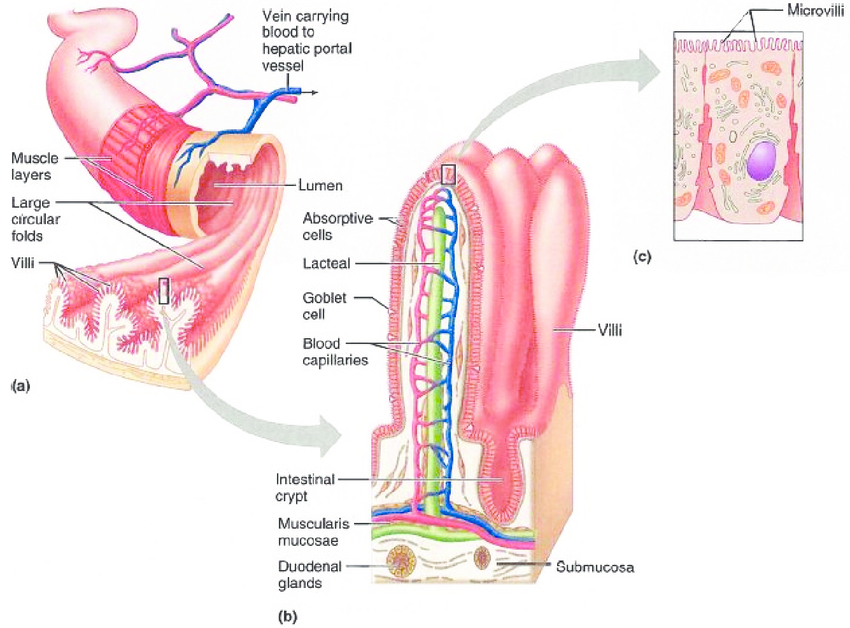
Como contraste podemos pensar en las células que tapizan nuestro intestino. Los enterocitos tienen una tasa muy alta de renovación, de tal manera que en 1 semana está renovadas todas estas células en los 8 metros aproximados de intestino.
Así que una toxina, una bacteria, un virus o cualquier agente agresivo tiene que vencer la tasa de replicación de nuestro sistema digestivo. O sea, que la infección intestinal que cogemos, por poner un ejemplo, tiene que ser capaz de dañar a los enterocitos a más velocidad de la que ellos se replican y recambian. Y aunque tengan éxito (y tengamos un cuadro de enteritis con náuseas, vómitos, diarrea), en pocos días la función está completamente recuperada: enterocitos nuevos reemplazan a los dañados y todo vuelve a la normalidad.
Imaginémonos un daño puntual en la mácula: un problema de falta de riego, o una inflamación, o una exposición intensa a la radiación (como ocurre cuando miramos un eclipse sin protección, o un láser que apunta al ojo). Si nuestros fotorreceptores se regeneraran como lo hacen las células del intestino, ¿qué pasaría? Que perderíamos la visión durante unos días, y luego las células dañadas se regenerarían y volveríamos a ver.
En el caso de que la enfermedad dañe la mácula de forma mantenida y no puntual, como la degeneración macular asociada a la edad (podríamos también meter aquí al edema macular, aunque esta condición es potencialmente reversible), si nuestros conos y bastones se regeneraran, también estaríamos mejor protegidos: el daño que produce la enfermedad sobre las células tendría que ser mucho más intenso, tendría que sobrepasar nuestra capacidad de regeneración. No como ocurre ahora: la enfermedad tiene todo el tiempo del mundo para ir deteriorando nuestros fotorreceptores.
Otras enfermedades de la retina
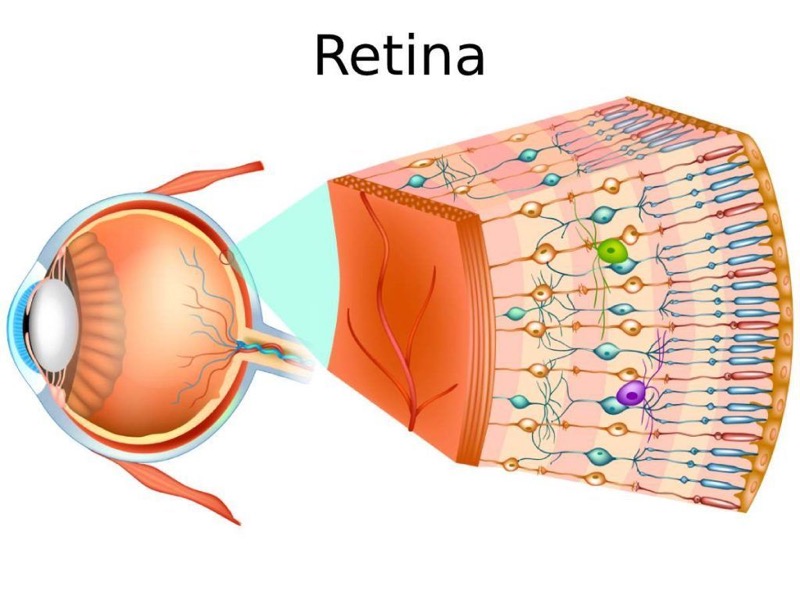
Hemos hablado de los fotorreceptores, pero al resto de la retina que no es epitelio pigmentario le pasa lo mismo (3). Hablamos de neuronas, varios tipos diferentes de neuronas (bipolares, horizontales, ganglionares) que tienen una función esencial en el proceso visual. Como hablábamos al principio, las neuronas no tienen (casi) capacidad de regeneración. Así que cualquier enfermedad que ponga en peligro cualquier capa de la retina (no solo los fotorreceptores, cualquier clase de neuronas) tiene potencial de afectar la visión de manera relativamente rápida e irreversible, si lo comparamos con los tejidos que sí regeneran sus células.
Así que podemos incluir la gran mayoría de las enfermedades de la retina (con excepción quizás de las genéticas): el desprendimiento de retina, las inflamaciones, las infecciones, los problemas circulatorios (tanto venosos como arteriales), los degenerativos (como la miopía alta), y un largo etcétera. Se dañan conos, bastones, neuronas que no se regeneran. Y por eso enfermamos y perdemos visión.
Si las células retinianas tuvieran capacidad de regeneración no existirían la práctica totalidad de las enfermedades actuales, o como mucho serían un inconveniente pasajero.
Pero si la retina pudiera regenerarse, posiblemente no tendría la capacidad de recibir y procesar la imagen.
Cristalino
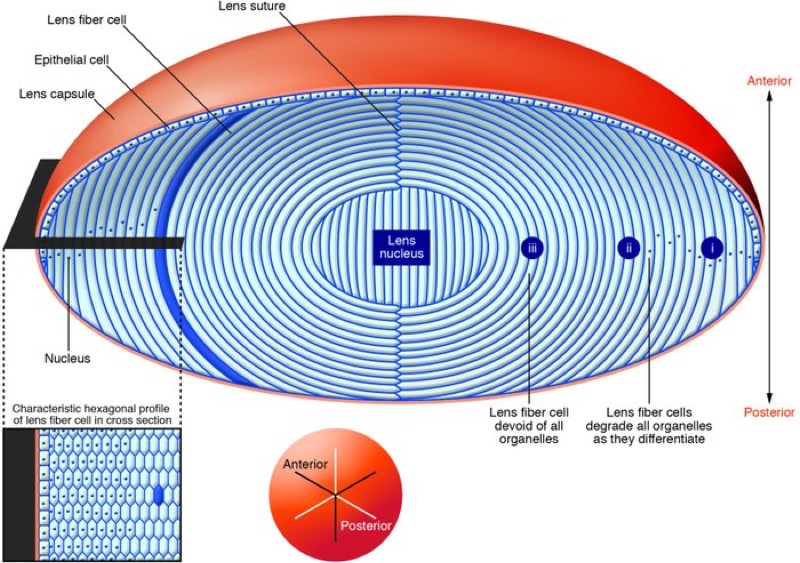
Como decíamos al principio, las células que hay en el interior del cristalino (nuestra lente intraocular, la que cambia de forma para enfocar los objetos cercanos) no se regeneran. Estas células son las que van recambiando las proteínas que confieren las características a nuestra lente. Gracias a que esas inmensas macroproteínas extracelulares mantienen una composición, ordenación y situación regular, simétrica y determinada, nuestro cristalino es transparente y elástico.
Con el paso del tiempo, y es un proceso que nos ocurre a todos los humanos si vivimos los suficiente, el cristalino va perdiendo transparencia. Y también se vuelve más rígido. Es lo que llamamos catarata. La causa más frecuente de pérdida visual que no se soluciona con corrección óptica.
De hecho, el proceso de «envejecimiento» del cristalino, los cambios en la transparencia y la coloración no comienzan cuando ya somos mayores. Se inician poco a poco desde el nacimiento. Y no es hasta, normalmente, pasados los 50-60 años cuando el proceso afecta esencialmente a nuestra visión, y es cuando hablamos de «cataratas». Pero la catarata es el proceso final de la degeneración del cristalino. Esas grandes proteínas, que confieren un cristalino tan transparente y flexible al recién nacido, poco a poco van «perdiendo calidad», y su disposición no es tan perfecta. Un proceso imparable, de tal manera que en el joven de 20 años, que no tiene catarata, ya podemos ver cambios degenerativos. Ya ese cristalino no es tan transparente y deformable como el del bebé.
Aquí nos metemos en el terreno de la especulación, pero, ¿esta degeneración del cristalino, imparable, que se inicia desde que nacemos y acaba en la catarata, se debe a que las células del cristalino van muriendo y no se regeneran? No podemos contestar con seguridad esa pregunta, pero tenemos motivos para pensar que sí, por lo menos en parte. Y no sería absurdo pensar que si estas células pudieran regenerarse, el cristalino podría mantener su buen estado de forma indefinida. De esta forma, no existirían las cataratas seniles.
Metiéndonos más en el terreno de la especulación, no sabemos si esta degeneración en el cristalino juega un papel en la vista cansada. A partir de los 45-50 años nuestra capacidad de enfocar de cerca (leer, utilizar el móvil, etc) se afecta de forma que solemos necesitar gafas para leer, o alguna solución similar (muchos miopes se tienen que quitar sus gafas para enfocar de cerca, por ejemplo).
Esto de enfocar de cerca le pasa como lo que explicábamos de la catarata: vamos perdiendo capacidad desde que nacemos, pero solo después de los 40-50 años esta pérdida se hace evidente en nuestras actividades diarias. No está claro por qué ocurre esto. Pero si la pérdida de flexibilidad, la «esclerosis» del cristalino juega un factor, podría ser que un «cristalino inmortal», con células que se regeneran y lo mantienen joven, no padeciera de vista cansada. Personalmente, creo que la pérdida de acomodación (de enfocar de cerca) es más compleja y no ocurriría de esta manera. Pero quién sabe, puestos a especular.
Córnea
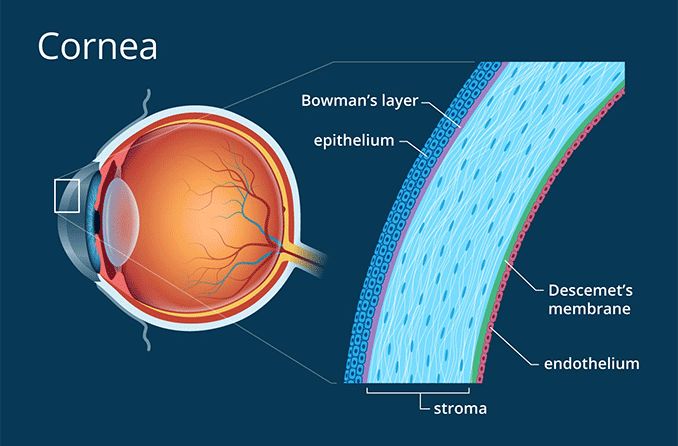
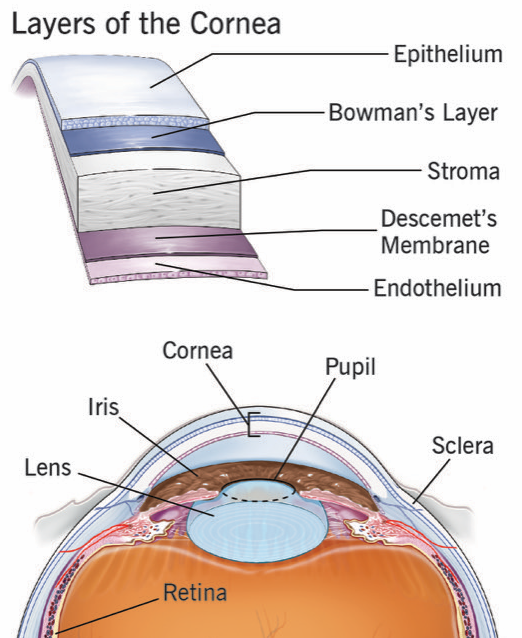
La córnea, ese tejido transparente que hace de lente y que permite que entre la luz por la parte delantera del ojo, es uno de las partes más interesantes del ojo. Y también el lugar de un gran número de enfermedades. Tiene 5 capas, pero dos de ellas son algo así como membranas basales, delgadas membranas de proteínas densamente organizadas que hacen de separación entre dos tejidos más grandes. Para entender mejor a la córnea podemos pensar que hay 3 grandes capas de tejidos, y dos «láminas» que hacen de límite entre las capas adyacentes.
En la parte más externa tenemos al epitelio corneal. Este epitelio, en contacto con la película lagrimal y el exterior, recibe muchas agresiones: sequedad, microtraumatismos (o traumatismos no tan pequeños), elementos extraños, bacterias, virus. Funciona un poco como el epitelio del intestino que hemos explicado antes: está en contacto con un medio muy hostil, pero por suerte tiene una tasa muy alta de regeneración. De manera que se recupera muy bien si el daño no es muy grande.
Por debajo del epitelio está el estroma, la capa de proteínas transparentes, un poco parecida al cristalino, que ocupa más del 90% del grosor de la córnea. Tiene también células, aunque menos que el epitelio corneal, que son todo células. El estroma es básicamente proteínas bien organizadas, y unos «pocos» queratocitos que realizan una función de mantenimiento, un poco parecido a lo que explicamos con el cristalino. Estas células no suelen multiplicarse, pero pueden hacerlo en caso de necesidad.
Por último (4), en la parte interna de la córnea, y en contacto con el interior del ojo y el humor acuoso, tenemos al endotelio. Es una sola capa de células (no como el epitelio, que es un tejido con varias capas, una encima de otra), y tiene una función muy importante: sacar agua del estroma. ¿Por qué?
Bueno, la transparencia de la córnea, el hecho de que una capa tan gruesa como el estroma (mide poco más de medio milímetro, pero una capa de proteínas de este espesor suele ser opaca) sea transparente se debe a una organización espacial muy peculiar. Las fibras de proteínas (principalmente colágeno) que constituyen el estroma están colocadas de forma paralela y regular, con una separación fija y determinada. Si las fibras se separan más, aunque sea contraintuitivo de entender, se pierde transparencia. El problema es que el colágeno y las demás proteínas son, como es habitual, hidrofílicas. Eso quiere decir que tienen apetencia por las moléculas de agua. Atraen el agua, y ésta se queda «enganchada» (por enlaces químicos débiles) a las proteínas. En un estado espontáneo, en un medio acuoso, el estroma de la córnea no puede mantener una organización o disposición que le permita ser transparente. El agua llega los espacios entre las fibras de colágeno, y la córnea adquiera un color blanco. Se vuelve opaca. Esa «apetencia» por el agua convierte al estroma en una esponja ávida que «succiona» moléculas de H2O tanto desde el epitelio corneal y la película lagrimal (en menor medida) como sobre todo del interior del ojo, del humor acuoso.
Es como si la córnea fuera un barco que tiene una vía de agua, y que está bajo la amenaza constante de hundirse. Un exceso de agua tiende a entrar constantemente y amenaza con la viabilidad del tejido.
En este contexto, ¿qué es lo que hace el endotelio? Sacar el agua del estroma, de vuelta al humor acuoso, al interior del ojo. Es como una bomba de agua: saca iones de sodio desde el endotelio hacia el acuoso, de forma que el sodio arrastra el agua fuera de la córnea. En el ejemplo del barco, es como tener una bomba de agua que está constantemente achicando agua para no hundirse.
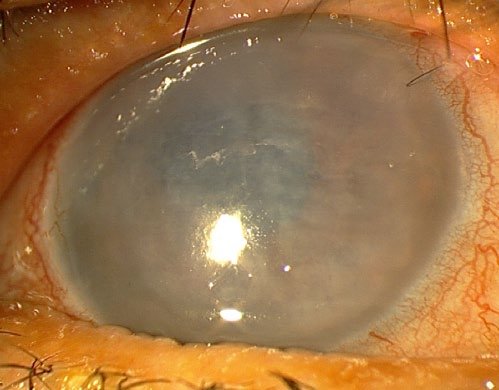
Cuando tenemos una inflamación de la córnea, una infección u otra causa que aumenta la entrada de agua, sobrepasando la capacidad del endotelio, entonces se produce un edema corneal. La zona de la córnea afectada pierde transparencia, se vuelve blanca. Cuando desaparece el problema (curamos la inflamación o la infección, por ejemplo), el endotelio recupera el equilibrio y la córnea vuelve a ser transparente.
Cuando el endotelio pierde momentáneamente su capacidad de sacar el agua, como por ejemplo en el glaucoma agudo, se produce también un edema corneal, esta vez difuso, de toda la córnea. Nuevamente, cuando resolvemos el problema, la córnea recupera su transparencia.
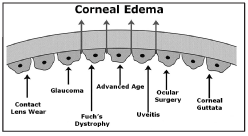
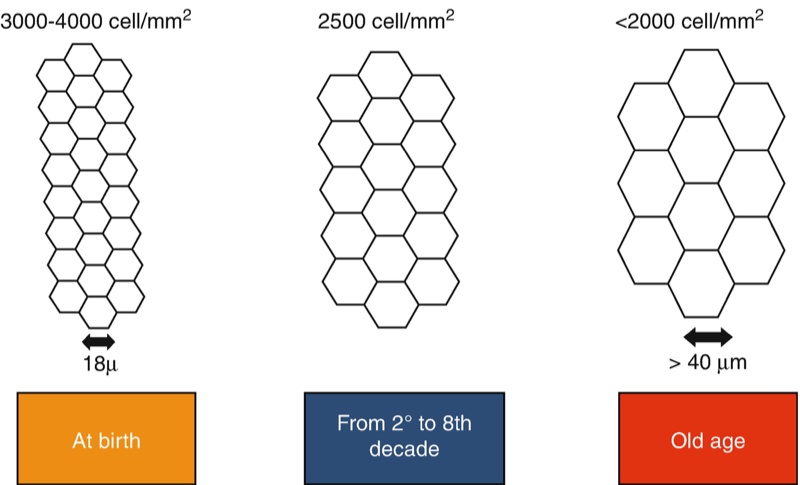
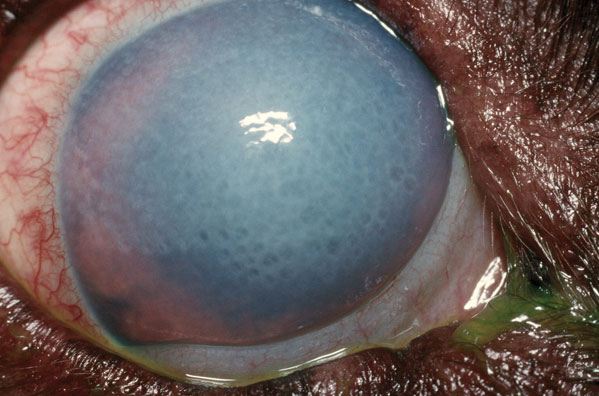
El auténtico problema es cuando el propio endotelio se afecta de forma más seria. Y sí, ya lo podemos adivinar: al contrario que el resto de células de la córnea, las células endoteliales no se regeneran. Vamos perdiendo células poco a poco desde que nacemos, pero en general suelen quedar las suficientes para mantener la transparencia corneal durante toda nuestra vida. A veces incluso más.
Pero si una enfermedad, un traumatismo, una cirugía (la de cataratas sería la más frecuente, pero no la única) acelera de forma drástica esta pérdida celular, el número total de éstas puede acabar por debajo de un umbral crítico, y entonces la córnea ya no puede restablecer su equilibrio acuoso. El agua que entra de forma pasiva, «colándose» por los huecos, desde el humor acuoso hacia el estroma, no se puede compensar con la extracción de agua que hacen las células endoteliales restantes.
Esta condición se llama descompensación corneal, queratopatía bullosa o insuficiencia endotelial. Y es el resultado de muy diversas condiciones y enfermedades. Desde una enfermedad propia del endotelio (distrofia de Fusch) a la complicación de una cirugía de catarata, por poner dos ejemplos frecuentes.
Y esto no se soluciona solo. Hay remedios no quirúrgicos que pueden controlar el problema hasta cierto punto, si la descompensación no es muy intensa. Pero como solución final requiere una cirugía de córnea: o bien cambiar toda la córnea (transplante «completo» de córnea o queratoplastia penetrante) o bien cambiar solo el endotelio.
Las queratopatías bullosas, si bien no muy conocidas por el público general, es un problema frecuente que ocupa una parte importante de las consultas de oftalmología. Y causan pérdida visual, dolor y complicaciones a los pacientes.
Volviendo al razonamiento especulativo del artículo de hoy, si las células endoteliales de la córnea tuvieran capacidad de regeneración, esta enfermedad no existiría. No iríamos perdiendo células endoteliales con los años. Una cirugía ocular complicada podría dañar el endotelio de forma transitoria, pero en unos días todo volvería a la normalidad. Una gran parte de los transplantes de córnea que se realizan en la actualidad (y todos los transplantes de endotelio) se podrían evitar si estas células tuvieran capacidad regenerativa.
Conclusión
Si todas las células de nuestro ojo tuvieran capacidad de multiplicarse, la mayoría de las enfermedades del ojo no existirían. Casi todos los oftalmólogos nos quedaríamos sin trabajo. Y eso sería fantástico. No existiría casi ninguna enfermedad en la macula o el resto de la retina (adiós degeneración macular asociada a la edad, el edema macular se resolvería de forma mucho más fácil, el desprendimiento de retina sería mucho menos problemático, las diabetes y otros problemas circulatorios tendrían un impacto mucho menor). No tendríamos que operar de catarata. Quizás ni existiría la vista cansada. Y una gran parte de las enfermedades de la córnea tampoco existirían.
¿Estamos mal hechos? No, como decíamos al principio, la especialización celular, como en otras partes del cuerpo (cerebro, músculos) muchas veces debe pagar un precio: la pérdida de regeneración celular. Y el ojo requiere un número alto y diverso de células altamente especializadas. No se puede tener un órgano que funcione de forma tan exquisita, y que a la vez sea robusto y resistente a la degeneración progresiva o los daños externos.
——
(1) Si es que no nos han operado antes de cataratas, claro
(2) A partir de mioblastos, de células musculares primitivas o indiferenciadas que nos quedan residuales. Sin embargo esto pasa como con las neuronas: se han encontrado mioblastos con limitada capacidad de regenerar las fibras musculares dañadas, pero en la actualidad se cree que es una capacidad muy restringida.
(3) Las células de Müller, una especie de grandes células de sostén que serían como fibroblastos modificados, también tienen potencial de multiplicarse. Pero no forman parte de la retina que tiene función directa sobre el proceso visual.
(4) Para completar el listado de 5 capas de la retina, nos quedan las dos membranas basales de separación. Lo que separa el epitelio del estroma es la membrana de Bowman. Y lo que separa el estroma del endotelio es la membrana de Descemet.